Pourquoi il n’y a aucune preuve que le “SARS-CoV-2” soit contagieux et responsable d’une maladie
Il y a des doutes sur l’efficacité des masques, des confinements, des passes sanitaires, de la distanciation sociale, des vaccins, des modes de transmissions, de la période d’incubation, de l’infectiosité des asymptomatiques, de la pertinence des tests PCR, mais le fondement, le virus, est inattaquable.
C’est établi, tout le monde le sait, il y a des milliers d’études, le SARS-CoV-2 est le virus responsable de la grille de symptômes appelée COVID-19.
Il y a d’ailleurs trois études qui affirment démontrer que ce virus est contagieux et responsable d’une maladie, chez l’animal certes, éthique oblige, mais s’il fallait une preuve pour ceux qui douteraient (qui douterait d’une évidence ?), c’est bien dans ces articles que nous la trouverons.
Souris
Le premier est une étude chinoise publiée le 07 mai 2020 dans la revue Nature, La pathogénicité du SARS-CoV-2 chez les souris transgéniques hACE2, elle affirme “confirmer la pathogénicité du SARS-CoV-2 chez les souris hACE2”.
Les souris hACE2 sont modifiées génétiquement pour qu’elles expriment l’ACE2 humain (hACE2), enzyme de conversion de l’angiotensine 2, présente dans pratiquement tous les organes chez l’homme et identifiée comme le récepteur fonctionnel du SRAS.
L’expérience est simple, il y a trois groupes de souris :
Le premier groupe est constitué des souris transgéniques (hACE2) à qui on inocule nasalement après anesthésie avec Avertin l’isolat du SARS-CoV-2 (un isolat en virologie n’est pas un isolat comme en bactériologie, l’isolat est ici une culture cellulaire sur cellules rénales de singes Vero contenant de la L-glutamine, du glucose, du pyruvate de sodium, du bicarbonate de sodium, du sérum bovin fœtal, de la pénicilline et de la streptomycine) ;
Le deuxième groupe est constitué de souris sauvages normales à qui on inocule l’isolat de la même manière ;
Le troisième groupe est constitué de souris transgéniques à qui on inocule nasalement une solution saline (tampon phosphate salin).
De légers poils hérissés et une perte de poids a été observé uniquement chez les souris hACE2 inoculée, atteignant 8% 5 jours après l’infection puis revenant rapidement à la normale, aucun autre signe clinique n’a été détecté.
Si des poils hérissés et une perte de poids ne correspond pas forcément aux symptômes observés chez l’homme, il s’agit de souris et on peut envisager qu’elles réagissent différemment.
Cette expérience présente néanmoins certaines lacunes qui peuvent faire douter de la pertinence des résultats obtenus.
Premièrement l’expérience témoin, les scientifiques déclarent utiliser un isolat, mais le terme n’est pas approprié puisque la solution s’apparente plus à une soupe de matériels génétiques provenant de trois espèces différentes et de produits toxiques, cette solution ne contient pas uniquement le virus. Il serait très simple de reproduire la même culture cellulaire sans y ajouter l’isolat de SARS-CoV-2 et de l’inoculer au groupe témoin, pourtant, seule une solution saline est utilisée.
Aurait-on obtenu les mêmes résultats si les souris du groupe témoin avaient été traitées de la même manière ?
Les scientifiques n’ont peut-être pas jugé utile de pratiquer cette expérience, car ils inoculaient également les souris sauvages de la même manière que les souris transgéniques, elles n’ont d’ailleurs pas présenté de symptômes (perte de poids et fourrure hérissée). Mais comme l’expérience témoin sur les souris transgéniques est questionnable, il n’est pas établi que les produits de la culture cellulaire seuls ne provoquent pas une réaction différente entre souris sauvages et souris hACE2.
Toute modification génétique entraîne des réactions imprévisibles, on sait par exemple que les souris transgéniques surexprimant l’ACE2 dans le cœur présentent une mort subite due à des arythmies cardiaques. L’explication possible de ce phénotype défavorable peut être liée à un rôle non défini de l’ACE2 au cours du développement. Il est probable que la surexpression chronique de l’ACE2 et/ou de l’Ang-(1-7) puisse induire des anomalies du développement chez les souris transgéniques.
Les résultats de cette étude utilisant des souris génétiquement modifiées sont donc difficilement interprétables, il est possible que les méthodes seules utilisée dans cette expérience, en dehors du virus fourni par une autre équipe de chercheurs, conduisent aux mêmes résultats.
Cette étude avait également fait scandale à sa première parution, car des manipulations au niveau des photographies histopathologiques avaient été détectées par Elisabeth Bik, une consultante en microbiome et intégrité scientifique.

https://twitter.com/MicrobiomDigest/status/1260030238987128833
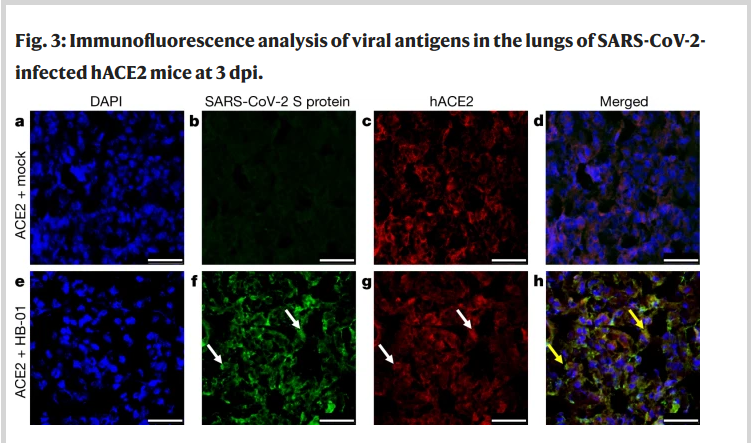
La figure 3 pose aussi question,
“nous avons démontré la colocalisation de la protéine S du SARS-CoV-2 (Fig. 3f) et du récepteur humain ACE2 (Fig. 3g) dans les cellules épithéliales alvéolaires des souris hACE2 infectées par HB-01 en utilisant l’immunofluorescence, à 3 dpi (Fig. 3h). Ce phénomène n’a pas été observé chez les souris hACE2 traitées par tampon phosphate salin (PBS) (Fig. 3a-d) ou chez les souris de type sauvage infectées par HB-01 (données non présentées), ce qui indique que le SARS-CoV-2, comme le SARS-CoV, utilise l’ACE2 humain comme récepteur d’entrée.”

Il aurait été plus pertinent de comparer les résultats des souris sauvages inoculées avec ceux des souris transgéniques pour démontrer ce point, il est tout à fait possible que la protéine S soit détectée simplement par ce qu’elle a été inoculée, indépendamment du récepteur hACE2, et dans ce cas une image d’une souris sauvage inoculée chez qui on ne détecterait pas la protéine S donnerait plus de crédibilité à l’étude.
Cette étude apporte donc difficilement une preuve irréfutable du lien entre le matériel génétique utilisé et la perte de poids et la fourrure hérissée des souris transgéniques, mais d’autres études de ce type pourront peut-être répondre aux différents points soulevés.
Hamsters
Le deuxième article est une étude chinoise publiée le 3 décembre 2020, “Simulation des manifestations cliniques et pathologiques de la maladie à coronavirus 2019 (COVID-19) dans un modèle de hamster doré syrien : Implications pour la pathogenèse et la transmissibilité de la maladie“
Cette race de hamster a été choisie en raison de la similarité entre l’ACE2 humain et celui de l’animal.
L’expérience utilise des méthodes similaires à la première sur les souris, un groupe de 11 est inoculé intranasalement avec “l’isolat” du SARS-CoV-2, et un groupe de 3 avec une solution saline. Seuls les anesthésiants changent, ici de la kétamine et de la xylazine.

“Les animaux exposés au SARS-CoV-2, mais pas ceux inoculés avec la solution saline (PBS), ont présenté une perte de poids corporel moyenne progressive allant jusqu’à environ 11 % de 1 à 6 jours, puis ont progressivement repris leur poids à 14 jours (figure 2A). Ils ont développé une léthargie, une fourrure ébouriffée, une posture de dos voûté et une respiration rapide depuis 2 dpi et ont commencé à se rétablir à 7 dpi. Aucun des animaux infectés par le SARS-CoV-2 et des animaux infectés par le virus fictif n’est mort.”
Cette étude présente donc les mêmes défauts que la première concernant l’expérience témoin, il y a aussi une différence importante de hamsters utilisés (11 contre 3) induisant une variation des paramètres de poids plus important entre la moyenne des deux groupes et une absence de groupe témoin pour les images histopathologiques des voies respiratoires (disponible pour la rate et l’intestin, ce qui représente peu d’intérêt).
Dans la deuxième partie de l’étude, des hamsters inoculés (n=3) avec l’isolat sont mis dans la même cage que des hamsters sains non inoculés (n=3) pour étudier l’infectiosité.

Le groupe inoculé présente une perte de poids corporel moyenne progressive allant jusqu’à environ 15 % de 1 à 6 jours, le groupe contact naïf ne montre pas de perte de poids moyenne plus importante que le groupe inoculé avec solution saline, en fait ils gagnent même beaucoup plus de poids après 14 jours.
Il est noté : “Il est intéressant de noter que les animaux index ont présenté une perte de poids significativement plus importante (P < 0,05) que les animaux contacts entre 2 et 8 dpi.”
“La perte de poids minime chez les animaux contacts naïfs pourrait être liée à un inoculum viral plus faible par rapport à la dose intranasale unique élevée de virus reçue par les animaux index stimulés.”
Les scientifiques ne mentionnent à aucun moment les signes cliniques des hamsters contacts naïfs, peut-être n’en ont ils pas observés.
Ils concluent que l’expérience à marché, car les deux groupes de hamsters ont été testés positifs par test PCR, mais rien ne montre que les hamsters contacts soient tombés malades. Il est possible qu’une partie du matériel génétique inoculé aux hamsters index se soit répandu aux hamsters contacts sans induire le moindre symptôme, et que les hamsters index aient présenté des symptômes à cause des méthodes et produits contenus dans l’isolat.
Il est également précisé que “Les modifications histopathologiques et l’expression de la protéine virale N dans les cornets nasaux, la trachée, les poumons et les tissus extrapulmonaires des animaux de contact étaient similaires à celles des animaux contaminés (figure supplémentaire 5).”
La figure supplémentaire 5 en question :

Aucune précision sur la partie des voies respiratoires représentée, et le gène N semble être présent à l’état de trace par rapport aux autres images.
Cette deuxième étude montre donc difficilement le lien entre SARS-CoV-2 et une maladie chez le hamster, l’expérience de transmissions entre hamsters inoculés et hamsters contacts tend même à démontrer une absence d’infectiosité entre contacts (chez le hamster).
Macaques
La troisième étude, publiée le 12 mai 2020 par une équipe aux États-Unis, “Maladie respiratoire chez les macaques rhésus inoculés avec le SARS-CoV-2” est le modèle parfait pour étudier la contagiosité du SARS-CoV-2 sur un modèle non-humain, car l’ACE2 du macaque rhésus est 100 % identique à l’ACE2 humaine au niveau de la région d’interface.
8 macaques (4 mâles et 4 femelles) sont inoculés avec une culture cellulaire de compositions similaires aux isolats de la première et deuxième étude via une combinaison d’administration intranasale (0,5 ml par narine), intratrachéale (4 ml), orale (1 ml) et oculaire (0,25 ml par œil), cette fois aucune anesthésie n’est effectuée.
“Nous avons inoculé à huit macaques rhésus adultes l’isolat nCoV-WA1-202014 du SARS-CoV-2. Le premier jour après l’inoculation (dpi), tous les macaques ont montré des changements dans leur schéma respiratoire et leur piloérection (hérissement des poils), comme le reflètent leurs scores cliniques (Fig. 1a). Les autres signes de maladie que nous avons observés comprenaient une diminution de l’appétit, une posture voûtée, une apparence pâle et une déshydratation (Tableau 1 des données étendues). La toux a été entendue occasionnellement dans la pièce où les macaques étaient logés, mais n’a pas pu être attribuée à des macaques individuels. Les signes de la maladie ont persisté pendant plus d’une semaine, tous les macaques étant complètement guéris entre 9 et 17 dpi (Fig. 1a, Données étendues Tableau 1). Nous avons observé une perte de poids chez tous les macaques (Fig. 1b) ; la température corporelle a atteint un pic à 1 dpi mais est revenue à des niveaux normaux par la suite (Fig. 1c). Sous anesthésie, les macaques n’ont pas montré une respiration accrue ; cependant, tous les macaques ont montré des schémas respiratoires irréguliers (Fig. 1d).”
Nous noterons d’abord qu’aucune expérience témoin n’est effectuée, “Un système en double aveugle n’a pas été utilisé dans cette étude car tous les macaques ont été soumis au même traitement.”, une logique questionnable, le traitement auquel les macaques sont soumis étant potentiellement traumatique (les macaques ne sont pas anesthésiés et sûrement contentionné pour l’inoculation) et la culture cellulaire utilisée contenant beaucoup d’autres substances que le virus SARS-CoV-2, elle pourrait potentiellement induire une réaction toxique ou allergique.
Les scientifiques pointent eux-mêmes que le schéma respiratoire des macaques revient à la normale après anesthésie (pour euthanasie), indiquant que la modification de la respiration, ainsi que les autres symptômes, pourraient également être liés au stress induit par les méthodes physiques utilisées pour l’inoculation.

Les macaques sont également testés par PCR :
“L’excrétion virale était la plus élevée dans le nez (figure 2a) ; le virus a pu être isolé dans des écouvillons prélevés à 1 et 3 dpi, mais pas par la suite. Les charges virales étaient élevées dans les écouvillons de gorge immédiatement après l’inoculation, mais elles étaient moins constantes que dans les écouvillons de nez par la suite ; chez un macaque, les écouvillons de gorge étaient positifs à 1 dpi et à 10 dpi, mais pas entre les deux (Fig. 2a).”
Ces données semblent indiquer que la culture cellulaire inoculée rend positif le test PCR s’il est effectué sur les tissus inoculés. En mettant du matériel génétique chez les macaques et en retrouvant ce matériel génétique chez eux, on prouve donc que du matériel génétique a été inoculé à des macaques. La “charge virale” ne semble pas non plus augmenter comme on pourrait le penser si le virus se répliquait dans les cellules, il semble être excrété comme une particule exogène non-assimilable par l’organisme (du macaque).
Les images histopathologiques et des poumons sont difficilement interprétables en l’absence de groupe témoin soumis au même traitement (mais sans virus). Une inhalation pulmonaire de la culture cellulaire pourrait également provoquer les “changements” observés.
Nous avons donc revu ici les trois articles scientifiques majeurs utilisés pour démontrer la pathogénicité du SARS-CoV-2 et son lien de causalité avec la maladie Covid-19.
Si ils présentent quelques défauts méthodologiques, cela ne prouve toujours pas que le SARS-CoV-2 n’est pas contagieux et responsable du COVID-19 chez l’homme.
Pourquoi ?
Par ce que nous n’avons pas d’autres modèles pour expliquer la maladie, la biologie et la vie. Une maladie dite infectieuse doit être causée par un agent matériel unique, et l’élimination de cet élément d’origine inconnue (une chauve-souris, un pangolin, le voisin, qui ont eux même “attrapé ce virus” suite à sa formation par le biais de réactions chimiques aléatoires de la nature et de l’univers) ne peut être aboutie que par sa recherche et sa destruction. Le virus est une entité unique, aléatoire, sans but, que les cellules du corps répliquent jusqu’à leur éclatement, c’est ainsi.
Si l’alimentation, les carences, l’état psychique, le microbiome, les toxines et polluants ont un rôle sur la santé, c’est avant tout en jouant sur le système immunitaire qui permet de se battre contre les virus et bactéries pathogènes. L’homme a évolué depuis des milliers d’années en s’adaptant aux virus, à tel point que 8 % de son ADN en serait composé, il fait partie intégrante de notre code génétique.
Il est donc impossible que le SARS-CoV-2 ne soit pas contagieux, il est impossible que le SARS-CoV-2 ne soit pas responsable de la grille de symptômes appelée COVID-19, par ce qu’il est impossible que nous pensions autrement.
Antonin Pimousse